स्तन कैंसर मेटास्टेसिस के नियमन में काइनेज अवरोधक कॉकटेल का डिजाइन तैयार करना
CSIR ASPIRE
शोध सारांश
प्रयोगशाला में हम जो काम करते हैं, उसमें मेरे नाम के शुरुआती अक्षरों से समानता स्थापित हो गई है। इसका नाम डीडी है और इसका मतलब है विकास से बीमारी। हमारी प्रयोगशाला का ध्यान स्तनधारी विकास का अध्ययन करना, इन अध्ययनों से संकेत प्राप्त करना और इस प्रकार उन्हें रोग जीवविज्ञान को समझने के लिए लागू करना है जो वास्तव में मनुष्य को प्रभावित करते हैं। हम समझते हैं कि हम उच्च लक्ष्य बना रहे हैं लेकिन जब तक आप किसी चीज का सपना नहीं देखते, तब तक कैसे या क्या हमें उस सपने को प्राप्त करने के लिए प्रेरित करेगा... हम विभिन्न मॉडलों का उपयोग करते हैं- प्रोकैरियोटिक सिस्टम से लेकर सेल लाइन से लेकर माउस/चूहा और निश्चित रूप से मानव रोगी के नमूनों तक। इसलिए, हमारी प्रयोगशाला में किए गए शोध को मोटे तौर पर वर्गीकृत किया जा सकता है-
- विकास (प्री-इम्प्लांटेशन, पोस्ट-इम्प्लांटेशन, हेमटोपोइजिस, प्लुरिपोटेंसी सहित)
- रोग मॉडलिंग (स्तन कैंसर, ल्यूकेमिया)
वर्तमान में चल रहे शोध के लिए फोकस क्षेत्र में शामिल हैं:
- भ्रूण के प्री- और पोस्ट-इम्प्लांटेशन और प्री-एक्लेमप्सिया के दोषों में हिस्टोन एपिजेनेटिक
- हेमटोपोइजिस बनाम ल्यूकेमोजेनेसिस में क्रोमेटिन आर्किटेक्चर का विनियमन
- स्टेम सेल और सेंट्रोसोम
- स्तन कैंसर और प्री-एक्लेमप्सिया के लिए बायोमार्कर के रूप में हिस्टोन एपिजेनेटिक कारकों का मूल्यांकन
- बायोमैन्युफैक्चरिंग- स्मार्ट के रूप में संवर्धित मांस प्रोटीन
वर्तमान में इन 3 विषयों के अंतर्गत पीएचडी छात्रों को स्वीकार किया जा रहा है:
- प्लुरिपोटेंसी की अवस्थाएँ
- विकास और बीमारी में सेंट्रोसोम विनियमन
- महिला प्रजनन स्वास्थ्य
अनुसंधान कार्यक्रम
भ्रूण फाइब्रोब्लास्ट को ट्रांसक्रिप्शन कारक Oct4, Klf4, Sox2 और c-Myc के साथ ट्रांसड्यूस करने पर भ्रूण स्टेम कोशिकाओं (ESCs) के समान विशेषताओं वाले प्रेरित बहुलता स्टेम सेल (iPSCs) उत्पन्न होते हैं। अब तक, उन्हें विभिन्न प्रजातियों और विभिन्न प्रोटोकॉल के साथ अन्य दैहिक कोशिका आबादी से प्राप्त किया गया है। उनकी व्युत्पत्ति नैतिक और कानूनी रूप से कम समस्याग्रस्त और तकनीकी रूप से अधिक व्यवहार्य है। कोशिकाओं को बहुलता अवस्था में पुनः प्रोग्रामिंग करने के लिए वैश्विक एपिजेनेटिक रीमॉडलिंग की आवश्यकता होती है और एपिजेनेटिक परिवर्तन होते हैं, जिनमें से कुछ पुनः प्रोग्रामिंग के लिए आवश्यक होते हैं और अन्य जिनमें से कुछ अनजाने में प्रक्रिया के दौरान पेश किए जाते हैं। रोगी विशिष्ट स्टेम सेल उत्पन्न करना पुनर्योजी चिकित्सा के क्षेत्र में एक दीर्घकालिक लक्ष्य रहा है। ये कोशिकाएँ एक अनूठा मंच प्रदान करती हैं जिससे विभिन्न रोगों में यांत्रिक अंतर्दृष्टि प्राप्त की जा सकती है, इन विट्रो ड्रग स्क्रीनिंग की जा सकती है, संभावित उपचारों का मूल्यांकन किया जा सकता है और सेल रिप्लेसमेंट थेरेपी के साथ जीन की मरम्मत का पता लगाने के लिए। हम ट्रांसक्रिप्शन कारकों और एपिजेनेटिक संशोधनों पर ध्यान केंद्रित करेंगे जो प्लुरिपोटेंसी के प्रेरण को विनियमित कर सकते हैं। विभेदित कोशिकाओं को पुनः प्रोग्रामिंग करने के लिए संस्कृति की स्थिति पर बेहतर समझ के साथ, हम हृदय रोगों के क्षेत्र में नैदानिक अनुप्रयोगों के लिए उपयुक्त मानव iPSCs को कुशलतापूर्वक प्राप्त करेंगे।
Pluripotent factors (OCT4/NANOG) in iPSC colony
यूकेरियोटिक डीएनए को गतिशील तरीके से क्रोमेटिन में व्यवस्थित किया जाता है जो इसे विभिन्न सेलुलर प्रक्रियाओं के दौरान एक्सेस करने में सक्षम बनाता है। क्रोमेटिन के मुख्य प्रोटीन घटक हिस्टोन को सेलुलर आवश्यकताओं के अनुसार इस संगठन को संरक्षित या बदलने के लिए इकट्ठा, प्रतिस्थापित या एक्सचेंज किया जाना चाहिए। हाल के आनुवंशिक अध्ययनों से संकेत मिलता है कि विशिष्ट हिस्टोन संशोधन और संशोधित एंजाइम वैश्विक और ऊतक-विशिष्ट क्रोमेटिन संगठन दोनों में आवश्यक भूमिका निभाते हैं। विशेष रूप से, ये अध्ययन संकेत देते हैं कि सामान्य भ्रूण पैटर्निंग, ऑर्गेनोजेनेसिस और अस्तित्व के लिए हिस्टोन एसिटिलेशन और मिथाइलेशन के स्तर और पैटर्न को नियंत्रित करने वाले एंजाइम आवश्यक हैं। इसलिए हम विकासात्मक जीव विज्ञान के विभिन्न संदर्भों में इन कारकों की भूमिका पर ध्यान केंद्रित करेंगे।
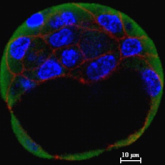
प्री-इम्प्लांटेशन E3.5 ब्लास्टोसिस्ट ई-कैडेरिन और हिस्टोन चैपरोन की अभिव्यक्ति को प्रदर्शित करता है
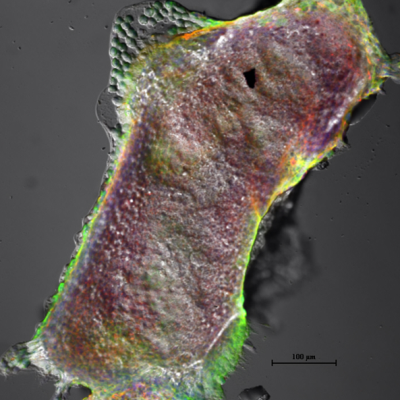
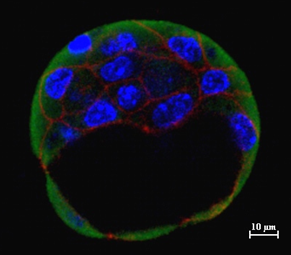
Post-implantation E5.5-E7.5 mouse embryo demonstrating the expression of E-Cadherin and histone chaperone
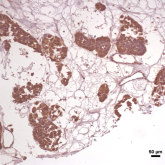
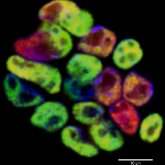
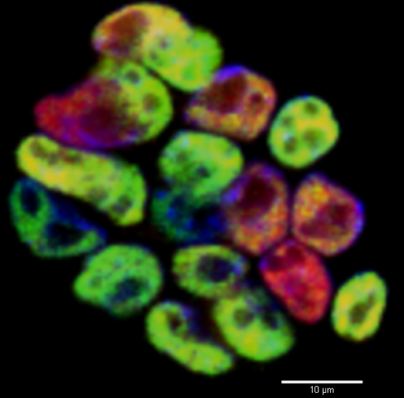
हम विभिन्न एपिजेनेटिक कारकों पर ध्यान केंद्रित कर रहे हैं जो स्तन कैंसर के आक्रामक या मेटास्टेटिक चरित्र को नियंत्रित या निर्देशित कर सकते हैं। इन कारकों की जांच करने के लिए ऊतक, मानव कोशिका रेखा और उसके बाद पशु मॉडल प्रयोगात्मक साक्ष्य का उपयोग मॉडल के रूप में किया जाता है।
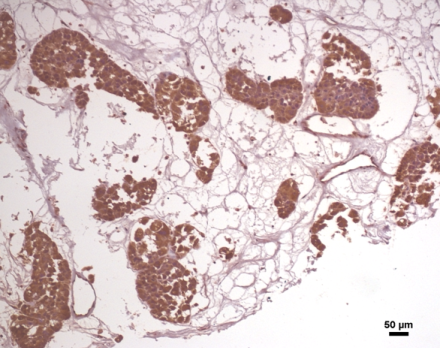
स्तन आईडीसी रोगी के नमूने में एपीएलएफ की अभिव्यक्ति
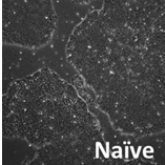
भ्रूण स्टेम कोशिकाओं के लिए बहुलता की दो अवस्थाएँ मौजूद होती हैं, प्राइम्ड और नैव। दुर्भाग्य से, मानव ES कोशिकाएँ आम तौर पर प्राइम्ड अवस्था में मौजूद होती हैं, जिससे उन्हें संवर्धित करना और सबसे महत्वपूर्ण रूप से उनके क्लोनल विस्तार के लिए मुश्किल हो जाता है। इसलिए, पुनर्योजी उद्देश्य के लिए hES कोशिकाओं के संभावित उपयोग को अधिकतम करने के लिए उन्हें परिवर्तित करना या उन्हें नैव अवस्था में प्राप्त करना बहुत ज़रूरी है। इसलिए, हम आणविक तंत्र और नैव मानव ES कोशिकाओं को विकसित करने के तरीके की जांच करने के लिए विभिन्न मूल से ES कोशिकाओं पर ध्यान केंद्रित कर रहे हैं।
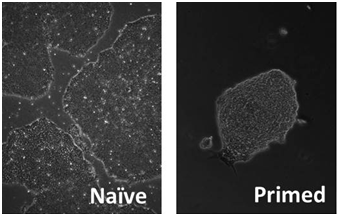
बहुलता की सरल बनाम तैयार अवस्था

दुनिया की सबसे बड़ी आबादी के साथ, भारत मांस और डेयरी उत्पादों की सबसे बड़ी खपत वाले देशों में से एक है और समय के साथ, इस मांग को पूरा करना मुश्किल होगा। इससे प्राकृतिक संसाधनों पर काफी दबाव पड़ेगा। पशुधन उत्पादन वैश्विक ग्रीनहाउस गैस उत्सर्जन का 80% हिस्सा है और 83% कृषि भूमि का उपयोग करता है। इसके अतिरिक्त, मनुष्यों को खतरा पहुँचाने वाली 60% ज्ञात और 75% नई संक्रामक बीमारियाँ जानवरों से आती हैं। इसलिए, बड़े पैमाने पर आहार संशोधनों के लिए प्रयास किए जा रहे हैं जो इन परिणामों को कम करने की संभावना रखते हैं। इसलिए, एक स्थायी विकल्प का उपयोग और प्रसंस्करण करना बहुत महत्वपूर्ण है जो आबादी की स्वस्थ आहार की आवश्यकता को पूरा कर सके। देश के संसाधनों का उपयोग करके स्मार्ट प्रोटीन का उत्पादन स्थायी स्वदेशी वैकल्पिक प्रोटीन प्रदान करेगा जो भारत और दुनिया को भी खिला सकता है।
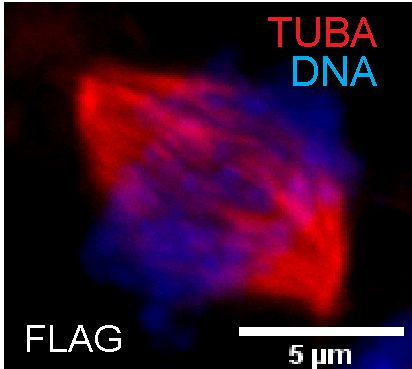
स्तन कैंसर जैसी बीमारी के दौरान या भ्रूण स्टेम कोशिकाओं (ईएससी) के प्रसार में सेंट्रोसोम दोहराव और इसकी संख्या में परिवर्तन या विचलन होता है जिससे जीनोमिक अस्थिरता होती है। हम हिस्टोन चैपरोन एपीएलएफ की भूमिका की जांच कर रहे हैं, जो कि एक किनेस भी है, सेंट्रोसोम दोहराव और इसकी संख्या को नियंत्रित करने में इसके विनियमन पर और इस प्रकार विकास और बीमारी में इसकी भूमिका।

प्री-इम्प्लांटेशन विकास पर हमारे अध्ययनों ने इम्प्लांटेशन में हिस्टोन चैपरोन की भूमिका को प्रदर्शित किया है। तदनुसार, हम देख रहे हैं कि यह अणु प्रीक्लेम्पसिया जैसी मातृ प्रजनन स्वास्थ्य से जुड़ी बीमारियों को कैसे नियंत्रित कर सकता है। हम गर्भवती महिलाओं (सामान्य और प्रीक्लेम्पसिया) से रक्त और प्लेसेंटा के नमूनों का विश्लेषण कर रहे हैं ताकि बायोमार्कर के रूप में इस अणु की भूमिका की जांच की जा सके। हम भ्रूण स्टेम कोशिकाओं और ट्रोफोब्लास्ट स्टेम कोशिकाओं से उत्पन्न ब्लास्टोइड या गैस्ट्रुलोइड के मॉडल का उपयोग करके हिस्टोन चैपरोन एपीएलएफ की अनुपस्थिति या उपस्थिति में गर्भावस्था से जुड़े विकारों के प्रेरण में शामिल आणविक तंत्र को समझने की भी कोशिश कर रहे हैं।
वर्तमान अनुसंधान अनुदान
-
2027 2024
-
2027 2024
स्टेम कोशिकाओं और विकास में सेंट्रोसोम दोहराव,
Department of Biotechnology [DBT]
-
2026 2023
विकास में EMT की देखरेख करने वाले APLF के डोमेन का विश्लेषण.
Science and Engineering Research Board [SERB]
-
2026 2023
ट्रोफोब्लास्ट स्टेम कोशिकाओं का एपिजेनेटिक विनियमन
Indian Council of Medical Research [ICMR]
-
2025 2022
सामान्य बनाम असामान्य हेमटोपोइजिस
Science and Engineering Research Board [SERB]
-
2023 2018
मेटास्टेटिक स्तन कैंसर
Department of Biotechnology [DBT]
पिछले/पूर्ण अनुसंधान अनुदान
-
बहुलता की अवस्थाएँ
Department of Biotechnology [DBT] 2017-2019हेमोजेनिक एंडोथेलियम
Department of Science & Technology [DST] 2013-2016VEGFR3 का ट्रांसक्रिप्शनल विनियमन
Council of Scientific and Industrial Research [CSIR] 2013-2016प्लुरिपोटेंसी में हिस्टोन चैपरोन
Department of Biotechnology [DBT] 2012-2015कोशिकीय संक्रमण
Department of Biotechnology [DBT] 2017-2020प्रसार और विभेदन में HIRA
Department of Science & Technology [DST] 2017-2020
