कैंसर स्टेम कोशिकाओं में PiwiL1 के विनियमन को समझना
Science and Engineering Research Board [DST-SERB]
शोध सारांश
मेरे शोध का मुख्य उद्देश्य सामान्य और कैंसर की स्थितियों में स्टेम सेल रखरखाव में गैर-कोडिंग आरएनए और संबंधित प्रोटीन की भागीदारी को समझना है। मेरे शोध में भ्रूण कार्सिनोमा स्टेम कोशिकाओं में मल्टीड्रग प्रतिरोध प्रोटीन के विनियमन के पीछे एपिजेनेटिक तंत्र की व्याख्या भी शामिल है।
अनुसंधान कार्यक्रम
फोटोरिसेप्टर को शामिल करने वाली रेटिनल गिरावट आयु से संबंधित धब्बेदार अध: पतन (ARMD) और रेटिनाइटिस पिगमेंटोसा (RP) का कारण है। सेल प्रतिस्थापन चिकित्सा ऐसी बीमारियों के लिए एकमात्र संभव उपचार है। विभिन्न स्रोतों से फोटोरिसेप्टर उत्पन्न करने के प्रयास किए गए हैं, विशेष रूप से hES कोशिकाओं से। स्टेम सेल थेरेपी में तीन प्रमुख पूर्वापेक्षाएँ शामिल हैं। वर्तमान शोध फोटोरिसेप्टर पीढ़ी की दक्षता बढ़ाने के लिए आंतरिक सेल मशीनरी की बारीक ट्यूनिंग पर केंद्रित है। हाल ही में, miRNAs को विभिन्न सेलुलर कार्यों में महत्वपूर्ण भागीदारी दिखाई गई है। miRNAs 18-22 न्यूक्लियोटाइड की लंबाई के छोटे RNA अणु होते हैं जो विभिन्न जीनों की अभिव्यक्ति को नियंत्रित करते हैं। हमने पाया कि miR क्लस्टर 143/145 सीधे Nrl को बांधता है और रोकता है और इस क्लस्टर की अधिक अभिव्यक्ति माउस रेटिना में फोटोरिसेप्टर को कम करती है। टेम्पोरल विश्लेषण ने माउस रेटिना में रेटिना विकास के विभिन्न चरणों में इन miRNAs के लिए एक विभेदक अभिव्यक्ति पैटर्न का खुलासा किया। फोटोरिसेप्टर विकास के दौरान वे डाउन-रेगुलेट होते हैं, जो इन विवो तंत्र का सुझाव देता है जो रॉड फोटोरिसेप्टर की पीढ़ी के लिए उनकी अभिव्यक्ति को नियंत्रित करता है। हमने एक ऑटोरेगुलेटरी तंत्र भी देखा जिसमें एनआरएल सकारात्मक रूप से miR क्लस्टर 143/145 को नियंत्रित करता है और फोटोरिसेप्टर पीढ़ी की दर को बनाए रखने के लिए इस ऑटोरेगुलेशन की आवश्यकता हो सकती है। फोटोरिसेप्टर विकास में विशिष्ट miRNAs को समझना महत्वपूर्ण है, क्योंकि उनकी अभिव्यक्ति में हेरफेर का उपयोग भविष्य में फोटोरिसेप्टर अपक्षयी रोगों के उपचार के लिए एक चिकित्सीय उपकरण के रूप में किया जा सकता है।
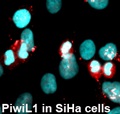
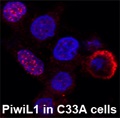
कैंसर के प्रमुख कारणों में से एक क्रोमेटिन स्तर पर एपिजेनेटिक विनियमन है और उत्परिवर्तन या परिवर्तन जैसे एपिजेनेटिक विनियामकों में कोई भी परिवर्तन ट्यूमरजनन को जन्म दे सकता है। एक सामान्य कोशिका को कैंसरग्रस्त कोशिका में बदलने से रोकने के लिए क्रोमेटिन रीमॉडलिंग गतिविधियों और एपिजेनेटिक विनियामकों का संतुलन बनाए रखना होगा। कैंसर से जुड़े एपिजेनेटिक परिवर्तन डीएनए मिथाइलेशन, हिस्टोन के सहसंयोजक संशोधन और क्रोमेटिन के साथ एपिजेनेटिक कारकों के जुड़ाव में परिवर्तन के माध्यम से प्राप्त किए जाते हैं। हालाँकि, अधिकांश एपिजेनेटिक कारक, जैसे कि डीएनए मेथिलट्रांसफेरेज़/डेमेथिलेज़ और हिस्टोन संशोधन एंजाइम, विशिष्ट डीएनए अनुक्रमों को नहीं पहचानते हैं। हाल के अध्ययनों से संकेत मिलता है कि पिवि प्रोटीन और संबंधित आरएनए अपने लक्ष्य स्थलों पर एपिजेनेटिक कारकों को भर्ती कर सकते हैं। यह समझना महत्वपूर्ण है कि कैंसर में एपिजेनेटिक परिवर्तन पिवि प्रोटीन द्वारा मध्यस्थ हैं या नहीं नहीं। यह अवलोकन कि Piwi प्रोटीन विभिन्न प्रकार के कैंसर में असामान्य रूप से व्यक्त किए जाते हैं और प्रसार, एपोप्टोसिस और सेल आक्रमण/मेटास्टेसिस में महत्वपूर्ण भूमिका निभाते हैं, कैंसर में एपिजेनेटिक विविधताओं में Piwi प्रोटीन की भागीदारी की संभावना का सुझाव देते हैं। Piwi प्रोटीन पर बढ़ते ध्यान के बावजूद, आणविक तंत्र को समझने के लिए केवल कुछ अध्ययन किए गए हैं जिसके द्वारा Piwi प्रोटीन ट्यूमरजनन या कैंसर कोशिकाओं में कार्य करने में योगदान करते हैं। यहाँ, इस अध्ययन में, हम उन नियामक RNA की पहचान करने की कोशिश कर रहे हैं जो Piwi प्रोटीन के साथ बातचीत कर रहे हैं और HPV से जुड़े उपकला कैंसर में उनके कार्यों की भी पहचान कर रहे हैं। HPV से जुड़े उपकला कैंसर में Piwi प्रोटीन की भूमिका को समझना और HPV के जवाब में कैंसर में उन्हें कैसे विनियमित किया जाता है, इसका नैदानिक स्तर पर प्रभाव पड़ेगा क्योंकि यह ऐसे कैंसर को संबोधित करने के लिए बेहतर नैदानिक और साथ ही चिकित्सीय दृष्टिकोण तैयार करने की अनुमति देता है।
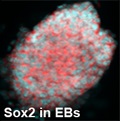
जर्म सेल ट्यूमर (GCT) घातक या गैर-घातक ट्यूमर होते हैं जो जर्म-सेल वंश से प्राप्त नियोप्लाज्म के हिस्टोलॉजिकल रूप से विषम समूह का प्रतिनिधित्व करते हैं। उनकी विविधता के बावजूद, वे सभी टोटिपोटेंट प्राइमर्डियल जर्म सेल (PGC) से उत्पन्न होने का अनुमान है। अधिकांश डिम्बग्रंथि और वृषण कैंसर जर्म सेल मूल के होते हैं। पश्चिमी देशों में, 20 से 40 वर्ष की आयु के पुरुष रोगियों में निदान किए गए सभी घातक रोगों में से 60% तक वृषण GCT (TGCT) के होते हैं। हिस्टोलॉजिकल रूप से, GCT को जर्मिनोमा और गैर-जर्मिनोमा में विभाजित किया जा सकता है। जर्मिनोमा (GERs; जिन्हें वृषण में सेमिनोमा और अंडाशय में डिस्जर्मिनोमा भी कहा जाता है) अविभेदित जर्म कोशिकाओं के ट्यूमर होते हैं जो प्लुरिपोटेंसी के मार्करों को बनाए रखते हैं। इसके विपरीत, गैर-जर्मिनोमा दैहिक-प्रकार के ऊतकों (टेराटोमा) या अतिरिक्त-भ्रूण संरचनाओं (योक सैक ट्यूमर (वाईएसटी) और कोरियोकार्सिनोमा) के समान दिखने के लिए विभेदन से गुजरते हैं। नॉनसेमिनोमा में एक या एक से अधिक हिस्टोलॉजिकल उपप्रकार होते हैं जो विभिन्न विभेदन वंशों और भ्रूण विकास के चरणों का प्रतिनिधित्व करते हैं। भ्रूण कार्सिनोमा कोशिकाएं स्टेम कोशिका घटक का प्रतिनिधित्व करती हैं, जिसमें भ्रूण और अतिरिक्त-भ्रूण ऊतकों की ओर विभेदित होने की क्षमता होती है। हालांकि जीसीटी दुर्लभ हैं, वे लगभग 2-4% बाल चिकित्सा कैंसर के लिए जिम्मेदार हैं और कैंसर 20 वर्ष से कम उम्र के किशोरों में होता है। ये ट्यूमर शरीर के अन्य भागों जैसे फेफड़े, यकृत, लिम्फ नोड्स, केंद्रीय तंत्रिका तंत्र में फैल सकते हैं लेकिन परिपक्व टेराटोमा, एक समान आनुवंशिक संरचना के बावजूद, GCTs की सामान्य रसायन संवेदनशीलता को साझा नहीं करते हैं। आंतरिक कीमोथेरेपी प्रतिरोध के कारण, परिपक्व टेराटोमा कीमोथेरेपी के बाद बचे हुए घावों के ~30-40% में पाए जा सकते हैं। मेटास्टैटिक GCT वाले 10-30% रोगी प्रारंभिक उपचार के बाद या तो अपूर्ण प्रतिक्रिया या रिलैप्स के कारण, एक टिकाऊ पूर्ण छूट प्राप्त करने में असमर्थ थे। हालाँकि अधिकांश GCTs कीमोथेरेपी के प्रति संवेदनशील होते हैं, लेकिन TGCTs जैसे घातक विभेदित GCTs कीमोथेरेपी के प्रति उच्च प्रतिरोध प्रदर्शित करते हैं। इस नैदानिक पृष्ठभूमि के आधार पर, चिकित्सीय परिणामों को और बेहतर बनाने के लिए ट्यूमर कोशिकाओं की रसायन संवेदनशीलता और प्रतिरोध के तंत्र की समझ अधिक महत्वपूर्ण होती जा रही है। उपचार के परिणाम का अधिक सटीक पूर्वानुमान कम या अधिक उपचार से बचने में मदद कर सकता है। यहाँ, प्रस्तावित अध्ययन में, हम प्लुरिपोटेंट स्टेम कोशिकाओं में बहुऔषधि प्रतिरोधी प्रोटीन के नियमन के तंत्र को स्पष्ट करने का प्रयास कर रहे हैं। चूंकि विशिष्ट कोशिकीय मार्गों को प्रभावित करने वाले उपकरण विकसित हो रहे हैं, इसलिए वे व्यक्तिगत प्रतिरोध तंत्रों को उलटने या उन पर काबू पाने में सहायक हो सकते हैं, जिससे भविष्य में अधिक रोगियों को ठीक करने में मदद मिल सकती है।
वर्तमान अनुसंधान अनुदान
-
2024 2021
पिछले/पूर्ण अनुसंधान अनुदान
-
डी एस टी एसईआरबी फास्ट ट्रैक अनुदान
Department of Science & Technology [DST] 2010-2013सीएसआईआर ईएमआर अनुदान
Council of Scientific and Industrial Research [CSIR] 2017-2020डीबीटी ईएमआर अनुदान
Department of Biotechnology [DBT] 2018-2020
