विकासशील/वयस्क प्रांतस्था में तंत्रिका स्टेम कोशिकाओं को व्यक्त करने वाले नॉच स्वतंत्र हेस-1 (NIHes-1) के एक अद्वितीय उपवर्ग की कार्यात्मक प्रासंगिकता
Science and Engineering Research Board [DST-SERB]
शोध सारांश
हमारी प्रयोगशाला का मुख्य ध्यान प्रारंभिक विकासात्मक संकेतों को समझना है जो तंत्रिका स्टेम सेल रखरखाव और भाग्य विशिष्ट भेदभाव को बढ़ावा देते हैं जो न्यूरोडीजेनेरेटिव रोगों के खिलाफ संभावित चिकित्सीय रणनीतियों को विकसित करने में प्रकाश डालेंगे। हमारे शोध कार्यक्रम बहुत स्पष्ट रूप से दो व्यापक कार्यक्रमों में वर्गीकृत हैं: 1) मूल संकेतों को समझना जो विभिन्न कार्यों जैसे तंत्रिका स्टेम कोशिकाओं के रखरखाव, भाग्य विनिर्देश, भेदभाव और कैसे विभेदित कोशिकाएं विकासशील मस्तिष्क के विभिन्न क्षेत्रों में उचित कनेक्शन बनाती हैं, के लिए जिम्मेदार हैं। हम विकासशील मस्तिष्क और रेटिना में इन मौलिक तंत्रों का अध्ययन विभिन्न बाहरी और आंतरिक घटकों जैसे नॉच और डब्ल्यूएनटी सिग्नलिंग, ट्रांसक्रिप्शन कारकों और तंत्रिका कोशिका रेखाओं और ट्रांसजेनिक/नॉकआउट माउस मॉडल में एमआरएनए को संशोधित करके करते हैं। हम भाग्य निर्दिष्ट न्यूरॉन्स/ऑर्गेनोइड्स उत्पन्न करने और इसकी चिकित्सीय क्षमता और पैथोफिज़ियोलॉजी को समझने के लिए ईएस कोशिकाओं, गर्भनाल रक्त से प्राप्त मेसेनकाइमल स्टेम कोशिकाओं और रोग मॉडल वाले आईपीएस कोशिकाओं का भी उपयोग करते हैं। उपर्युक्त को समझने के लिए हम मुख्य रूप से ट्रांसजेनिक/कंडीशनल नॉक आउट माउस मॉडल, अगली पीढ़ी के अनुक्रमण, इलेक्ट्रोफिजियोलॉजी और व्यवहार प्रयोगों पर निर्भर करते हैं।
अनुसंधान कार्यक्रम
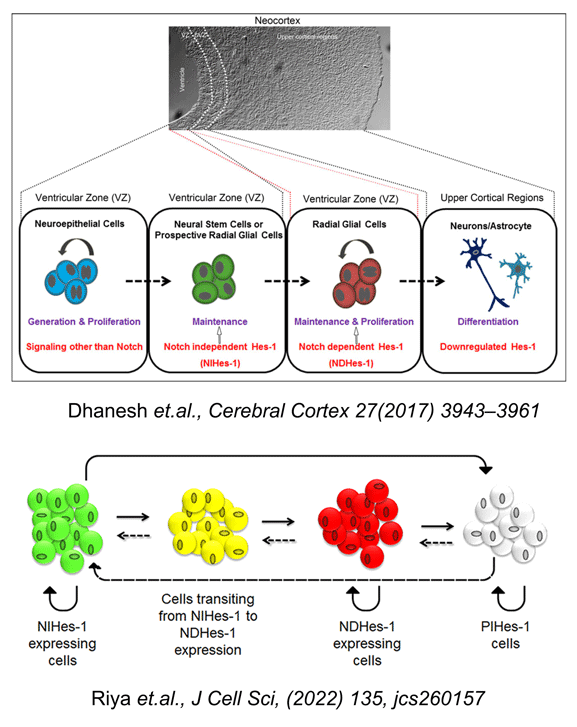
स्तनधारी तंत्रिका तंत्र के विकास के दौरान, न्यूरॉन्स और ग्लिया एक सामान्य जर्मिनल ज़ोन से उत्पन्न होते हैं जिसमें न्यूरल स्टेम सेल (NSCs) और न्यूरल प्रोजेनिटर (NPs) दोनों होते हैं। नियामक घटनाएँ जो इन दो प्रोलिफ़ेरेटिव न्यूरल सेल प्रकारों और उनके भाग्य के बीच अंतर करती हैं, अभी भी खराब तरीके से समझी जाती हैं। हमने पहले न्यूरल स्टेम सेल/प्रोजेनिटर आबादी की उपस्थिति को दिखाया है जिसे FGF2 द्वारा Hes-1 के सक्रियण के माध्यम से बनाए रखा जाता है, जो एक अच्छी तरह से स्थापित नॉच रिसेप्टर लक्ष्य है। आश्चर्यजनक रूप से इन कोशिकाओं में Hes-1 का यह सक्रियण नॉच से स्वतंत्र था और JNK-ATF2 सिग्नलिंग के माध्यम से गैर-विहित रूप से मध्यस्थता की गई थी (सनलकुमार एट अल। जे. न्यूरोकेम., 113 (2010) 807-818; सनलकुमार एट अल सेल. मोल. लाइफ. साइंस., 67 (2010) 2957-2968)। आगे रिपोर्टर सिस्टम के साथ गर्भाशय में इलेक्ट्रोपोरेशन का उपयोग करके हमारे परिणामों को विवो में एक्सट्रपलेशन करते हुए, हमने प्रदर्शित किया है कि विकासशील नियो-कॉर्टेक्स में, नॉच-स्वतंत्र Hes-1 (NIHes-1) अभिव्यक्ति तंत्रिका स्टेम कोशिकाओं तक सीमित है और नॉच-निर्भर Hes-1 (NDHes-1) अभिव्यक्ति तंत्रिका पूर्वज/रेडियल ग्लियल कोशिकाओं में पाई जाती है (धनेश एट अल, सेरेब्रल कॉर्टेक्स; 2016, 1-19, DOI: 10.1093/cercor/bhw207)। इसने मूल रूप से दो बहुत निकट से संबंधित आबादी के बीच महत्वपूर्ण अंतरों की जानकारी दी। हालाँकि Hes-1 अभिव्यक्ति तंत्रिका पूर्वज में बनी रहती है, लेकिन नॉच-स्वतंत्र से आश्रित अवस्था में संक्रमण इसे बहुलतापूर्ण बनाता है क्योंकि पूर्व तंत्रिका स्टेम कोशिकाओं को गैर-विभाजन/धीमी विभाजन अवस्था में बनाए रखता है, जबकि बाद वाला रेडियल ग्लियल कोशिकाओं के रखरखाव और प्रसार के लिए बहुत आवश्यक है।
नियोकॉर्टिकल विकास में नॉच सिग्नलिंग के अलावा, हमने Wnts द्वारा मध्यस्थता वाले एक अन्य सिग्नलिंग पर गौर किया क्योंकि wnt सिग्नलिंग ने CNS विकास में महत्वपूर्ण भूमिकाएँ दिखाई हैं। हमने देखा कि Wnt5a, एक गैर-विहित तरीके से, अनुमस्तिष्क विकास को नियंत्रित करता है जिसे स्पष्ट रूप से समझा नहीं गया है। अच्छी तरह से परिभाषित साइटोआर्किटेक्चर के साथ सेरिबैलम के विकास में भ्रूण और प्रसवोत्तर विकास के दौरान कई विनियामक तंत्र शामिल होते हैं। इस अध्ययन में, हमने सेरिबैलम में इसके कार्यात्मक महत्व के साथ-साथ Wnt5a के स्थानिक अभिव्यक्ति पैटर्न को उजागर किया है। नेस्टिन-क्रे मध्यस्थता वाले Wnt5a सशर्त नॉकआउट मॉडल का उपयोग करते हुए, हमने प्रदर्शित किया कि Wnt5a एक गतिशील तरीके से अनुमस्तिष्क GABAergic और glutamatergic तंत्रिका पूर्वजों के प्रसार की मध्यस्थता करता है जो परिणामस्वरूप विकास के शुरुआती और बाद के चरण के दौरान संबंधित न्यूरॉन्स (GABAergic और glutamatergic) के भेदभाव को प्रभावित करता है। इसके अलावा, हमने दिखाया कि Wnt5a अपने कार्य को गैर-विहित तरीके से करता है और आणविक स्तर पर प्रसार से जुड़े जीन जैसे साइक्लिन D1 और Sox2 की अभिव्यक्ति को नियंत्रित करता है जो हमारे इन विवो परिणामों के अनुरूप है। ये निष्कर्ष Wnt5a सिग्नलिंग को अनुमस्तिष्क विकास के महत्वपूर्ण नियामकों में से एक के रूप में साबित करते हैं। Wnt5a प्रसार को नियंत्रित करने वाले मार्ग की पहचान करने के लिए आगे की जांच से अनुमस्तिष्क रोग रोगजनन की बेहतर समझ में उपयोगी अंतर्दृष्टि मिल सकती है जो Wnt सिग्नलिंग के विनियमन के कारण होती है (सुबाशिनी et.al., Sci. Rep: 2017, 7, 42523; doi: 10.1038/srep42523).
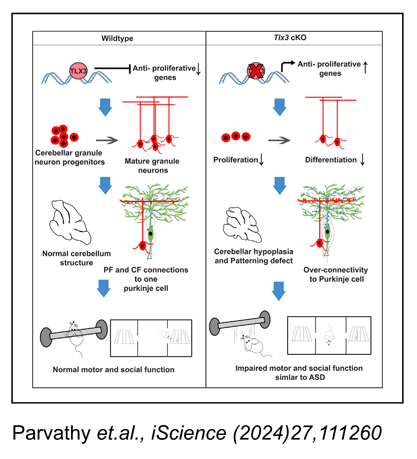
न्यूरोजेनेसिस एक विकासात्मक प्रक्रिया है जिसके द्वारा न्यूरल स्टेम कोशिकाओं से नए न्यूरॉन्स उत्पन्न होते हैं जबकि न्यूरोनल उपप्रकार प्रोजेनिटर पूल से भाग्य विनिर्देशन के माध्यम से उत्पन्न होते हैं। न्यूरोनल उपप्रकारों में मुख्य रूप से उत्तेजक और निरोधात्मक न्यूरॉन्स शामिल होते हैं जो क्रमशः ग्लूटामेट और GABA न्यूरोट्रांसमीटर का उपयोग करते हैं। विभिन्न कारक अत्यधिक परिष्कृत तरीके से न्यूरोजेनेसिस और न्यूरोनल उपप्रकार विनिर्देशन को नियंत्रित करते हैं। टर्मिनल चयनकर्ता जीन के रूप में जाने जाने वाले जीनों का एक समूह अपने पूरक भाग्य पर एक विशेष न्यूरोनल भाग्य को प्रेरित या निर्दिष्ट करने में सक्षम है। ऐसा ही एक महत्वपूर्ण जीन Tlx3 है जो होमोबॉक्स डोमेन ट्रांसक्रिप्शन कारकों के Tlx परिवार से संबंधित है, जिसे एक प्रमुख चयनकर्ता जीन के रूप में पहचाना गया है जो भ्रूण की रीढ़ की हड्डी में GABAergic भाग्य पर ग्लूटामेटेरिक न्यूरोनल भाग्य निर्धारित करता है। इसलिए, Tlx3 अभिव्यक्ति को नियंत्रित करने वाले कारकों को समझना आदर्श होगा। और Tlx3 को व्यक्त करने वाले पूर्वजों/न्यूरॉन्स का कार्यात्मक महत्व भी। हमने पाया कि Hes-1 तंत्रिका पूर्वजों के उत्तेजक बनाम निरोधात्मक भाग्य को तय करने में महत्वपूर्ण भूमिका निभा सकता है, Tlx3 जीन की अभिव्यक्ति को विनियमित करके जो ग्लूटामेटेरिक भेदभाव को बढ़ावा देने में शामिल है (इंदुलेखा et al., Cell. Mol. Life. Sci, (2012) 69:611-627). यह ज्ञात है कि Tlx3 सीएनएस के पोस्ट-माइटोटिक न्यूरॉन्स में व्यक्त किया जाता है और ग्लूटामेटेरिक भेदभाव को बढ़ावा देने के लिए जाना जाता है। इसके विपरीत, हमने पाया कि Tlx3 सेरिबैलम में बाहरी दानेदार परत के प्रोलिफ़ेरेटिंग प्रोजेनिटर में व्यक्त किया जाता है, और इस अभिव्यक्ति को नियंत्रित करने वाले कारकों की जांच की। Pax6-/-Sey माउस मॉडल और आणविक अंतःक्रिया अध्ययनों का उपयोग करके हमने प्रदर्शित किया कि Pax6 विशेष रूप से सेरिबैलम में Tlx3 का एक प्रमुख उत्प्रेरक है, और भ्रूण के दिन (E)15 से इसकी अभिव्यक्ति को प्रेरित करता है। प्रसवोत्तर दिन (पीएन) तक, Tlx3 को पश्च अनुमस्तिष्क लोब के अनुमस्तिष्क ग्रैन्युलर न्यूरॉन्स में अत्यधिक प्रतिबंधित तरीके से व्यक्त किया गया था, जहां यह निकोटिनिक कोलीनर्जिक रिसेप्टर-α3 सबयूनिट (Chrnα3) और सिनैप्टिक कनेक्शन और न्यूरोनल माइग्रेशन के निर्माण में शामिल अन्य जीनों की प्रतिबंधित अभिव्यक्ति के लिए आवश्यक है (दिव्या एट अल, साइंस रेप, (2016) 30337, DOI: 10.1038/srep30337)। Tlx3/Chrnα3 कैस्केड के बारे में हमारे निष्कर्षों की पुष्टि करने के लिए, हमने Chrnα3 अभिव्यक्ति का विश्लेषण किया और पाया कि Pax6-/- Sey सेरिबैलम में इसकी अभिव्यक्ति पूरी तरह से अनुपस्थित थी। इसके अलावा हमने देखा कि Chrnα3 को पोस्ट-माइटोटिक EGL में और संभावित IGL में माइग्रेट करने वाली कोशिकाओं में Tlx3 के साथ सह-अभिव्यक्त किया गया था। चूँकि Chrnα3 ऑटिस्टिक स्पेक्ट्रल डिसऑर्डर (ASD) जैसे न्यूरोडेवलपमेंटल विकारों से जुड़ा हुआ है, इसलिए हम वर्तमान में इस संभावना पर विचार कर रहे हैं कि क्या Tlx3 ASD में कोई भूमिका निभा सकता है।
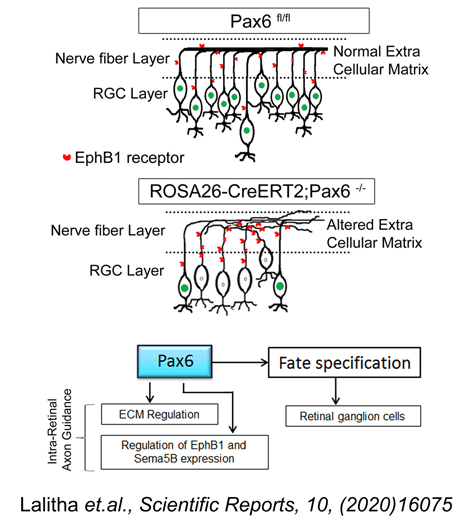
ग्लूकोमा दुनिया में अंधेपन का दूसरा सबसे बड़ा कारण है। यह एक दीर्घकालिक विकार है जो रेटिना गैंग्लियन कोशिकाओं (RGCs) और उनके अक्षतंतुओं के क्रमिक नुकसान के कारण होता है जो आंख से मस्तिष्क तक दृश्य जानकारी संचारित करते हैं। ऊंचा इंट्रा ऑक्यूलर प्रेशर (IOP) एटिऑलॉजिकल कारक बना हुआ है जिसके लिए प्रमुख उपचारात्मक प्रयास किए जा रहे हैं, हालांकि उपचार के किसी भी तरीके से खोए हुए RGC को वापस नहीं लाया जा सका और इसलिए दृश्य कार्य को बहाल नहीं किया जा सका। हम वर्तमान में ES कोशिकाओं को प्रत्यारोपित करके RGC की संख्या बढ़ाने के लिए एक संभावित विधि पर विचार कर रहे हैं जिन्हें RGC में विभेदित करने के लिए प्रेरित किया गया है। ऐसी रणनीति कुछ हद तक खोए हुए RGC को फिर से भरने में मदद करेगी। इस उद्देश्य के लिए हमारी प्रयोगशाला ने बाहरी विकास कारकों को संशोधित करके और न्यूरोजेनेसिस सिग्नलिंग मार्ग में हेरफेर करके ES कोशिकाओं से RGC उत्पन्न करने के लिए एक नए प्रोटोकॉल को सफलतापूर्वक अनुकूलित किया है (जगाथा एट अल। BBRC; 2009; 230-235)। ये ES कोशिका-व्युत्पन्न RGCs मेज़बान रेटिना में एकीकृत करने में सक्षम थे और ग्लूकोमा पशु मॉडल में प्रत्यारोपित किए जाने पर गैर-प्रत्यारोपित जानवरों की तुलना में बेहतर सेल एकीकरण और दृष्टि पुनर्प्राप्ति के माध्यम से कार्यात्मक साबित हुए। हमारे परिणामों ने दिखाया है कि ES कोशिका-व्युत्पन्न RGCs के प्रत्यारोपण द्वारा RGG क्षीण NMDA मॉडल में आंशिक दृश्य कार्यों को उलटा किया जा सकता है। उपरोक्त रणनीति की सफलता सेल प्रतिस्थापन चिकित्सा का उपयोग करके ग्लूकोमा का इलाज करने में मदद कर सकती है। तंत्रिका/आरजीसी भेदभाव के लिए विषम स्रोतों की पहचान करने के लिए एक समानांतर कार्यक्रम के हिस्से के रूप में हमने गर्भनाल रक्त-व्युत्पन्न मेसेनकाइमल स्टेम कोशिकाओं से पूर्वजों की एक बहुत ही अनूठी आबादी की पहचान की है जिसमें न्यूरॉन्स में विभेदित होने की एक अंतर्निहित क्षमता है (दिव्या एट अल। स्टेम सेल रिसर्च एंड थेरेपी, 2012; 3:57)। शेष MSCs को लंबी अवधि के लिए वृद्धि कारक जोखिम के संयोजन के साथ न्यूरॉन्स में ट्रांसडिफ़रेंशिएट किया जाना है। उपरोक्त समस्याओं को संबोधित करने के अलावा, हमारी प्रयोगशाला मस्तिष्क के दृश्य केंद्रों में आरजीसी भेदभाव और अक्षीय विस्तार में miRNAs और उनकी भूमिका की पहचान करने पर भी ध्यान केंद्रित करती है। रेटिना में miRNA द्वारा पोस्ट-ट्रांसक्रिप्शनल विनियमन में हाल ही में हुई प्रगति को देखते हुए हमने उन miRNAs पर गौर किया है जो संभावित रूप से RGC विशिष्ट मार्कर, Brn3b को लक्षित कर सकते हैं और इस तरह विकास के दौरान RGC भेदभाव को विनियमित कर सकते हैं। हमने Brn3b को विनियमित करने में शामिल miRNAs की भविष्यवाणी करने के लिए एक इन सिलिको दृष्टिकोण अपनाया और आगे के विश्लेषण के लिए mmu-miR-23a और mmu-miR-374 का चयन किया, क्योंकि इन दोनों को कई कार्यक्रमों द्वारा चुना गया था। हम पहली बार यह प्रदर्शित करने में सक्षम थे कि ये दो miRNAs, व्यक्तिगत रूप से नहीं बल्कि संयोजन में, रेटिना एक्सप्लांट संस्कृतियों की नाड़ीग्रन्थि कोशिका परत में Brn3b की अभिव्यक्ति को प्रभावित करेंगे। साथ ही, हम miR-23a और miR-374 के माध्यम से मध्यस्थता करने वाले Brn3b अभिव्यक्ति की लहर को नियंत्रित करने वाले एक समन्वित तंत्र के अस्तित्व के लिए सबूत प्रदान करते हैं, जो अंततः उनके पूर्वजों से RGCs के विकास और बाद में उनके अस्तित्व और अक्षतंतु मार्गदर्शन को विनियमित करेगा (रशीद एट अल 2014, विकासात्मक तंत्रिका जीव विज्ञान, 74: 1155-1171)। हालाँकि हमने वयस्क रेटिना में ES-NPs के एकीकरण और RGC मार्करों को व्यक्त करते हुए देखा है, लेकिन अक्षतंतु विस्तार और मार्गदर्शन जैसे कार्यात्मक विशेषताओं के बारे में विवरण का अभाव है। इसलिए, वर्तमान में हम अक्षतंतु विस्तार प्रक्रिया में शामिल अणुओं और cKO चूहों के मॉडल का उपयोग करके उनके विनियमन पर ध्यान केंद्रित कर रहे हैं।
वर्तमान अनुसंधान अनुदान
-
2025 2022
पिछले/पूर्ण अनुसंधान अनुदान
-
लक्षणविहीन कोविड-19 वाहकों की व्यापक स्क्रीनिंग के लिए कम लागत वाले एनोस्मिया स्क्रीनिंग उपकरण का विकास
Science and Engineering Research Board [DST-SERB] 2020-2021न्यूरोब्लास्टोमा में प्लियोट्रोपिक हेस-1 अभिव्यक्ति द्वारा स्टेमनेस का विनियमन
National Bioscience Career Award, Dept. of Biotechnology, Govt. of India 2018-2021विकासशील नियोकॉर्टेक्स का प्रतिनिधित्व करने वाले विशेष रूप से ईएस व्युत्पन्न ऑर्गेनोइड में नॉच स्वतंत्र हेस-1 (एनआईएचईएस-1) की अभिव्यक्ति: इसके कार्यात्मक महत्व को समझना।
Department of Biotechnology [DBT] 2018-2020रेटिना गैंग्लियन कोशिका अक्षतंतुओं को मस्तिष्क के दृश्य केंद्रों तक निर्देशित करना: क्या Pax6 प्रमुख अणु है?
Department of Science & Technology [DST] 2017-2020पैक्स6 द्वारा टीएलएक्स3 का ट्रांसक्रिप्शनल विनियमन और इन विट्रो और इन विवो में उत्तेजक तंत्रिका भाग्य विनिर्देशन पर इसकी भूमिका।
Kerala State Council for Science, Technology and Environment [KSCSTE] 2014-2016नॉच स्वतंत्र Hes-1 मध्यस्थता रखरखाव और तंत्रिका पूर्वजों के भाग्य विनिर्देशन की विशेषता।
Department of Biotechnology [DBT] 2013-2016नोच सिग्नलिंग द्वारा टीएलएक्स3 (होक्स11एल2) का ट्रांसक्रिप्शनल विनियमन और तंत्रिका पूर्वजों के उत्तेजक बनाम निरोधात्मक भाग्य विनिर्देशन में इसकी भागीदारी।
Department of Science & Technology [DST] 2013-2016चिकित्सीय अनुप्रयोगों के लिए यूसीबी स्टेम कोशिकाओं का वंश विशिष्ट कोशिका प्रकारों में विभेदन।
Department of Biotechnology [DBT] 2008-2011मानव भ्रूण स्टेम (ईएस) कोशिका रेखा का पृथक्करण और लक्षण वर्णन।
Kerala State Council for Science, Technology and Environment [KSCSTE] 2007-2009भ्रूण स्टेम (ईएस) कोशिकाओं से उत्पन्न रेटिनल गैंग्लियन कोशिकाओं (आरजीसी) का उपयोग करके ग्लूकोमा के इलाज के लिए एक सेल थेरेपी रणनीति का विकास।
Department of Biotechnology [DBT] 2006-2009दौरे पर संभावित नियंत्रण के लिए टेम्पोरल लोब मिर्गी से पीड़ित चूहों के हिप्पोकैम्पस में GABA उत्पन्न करने के लिए भ्रूण स्टेम (ES) कोशिकाओं का प्रत्यारोपण।
Department of Science & Technology [DST] 2004-2008
