कैंसर स्टेम कोशिकाओं के नियमन में ट्रांसक्रिप्शन इंटरमीडियरी फैक्टर1 γ (TIF1 γ) के E3-लिगेज स्वतंत्र कार्य का मूल्यांकन
SERB, Department of Science & Technology [DST]
शोध सारांश
भारत में ओरल कैंसर दूसरा सबसे घातक कैंसर है। 2 में से 1 मरीज में, उपचार के बाद रोग वापस आ जाता है (पुनरावृत्ति)। स्व-नवीनीकृत कैंसर कोशिकाएँ या कैंसर स्टेम कोशिकाएँ (CSCs) पुनरावृत्ति का कारण हैं। मेरी टीम भारत में ओरल कैंसर का अध्ययन करने के लिए एक राष्ट्रीय पहल का हिस्सा थी। अध्ययन से हमें जो सुराग मिले हैं, उन्हें आगे बढ़ाया जा रहा है। वर्तमान में हम आरजीसीबी और अन्य ब्रिक संस्थानों के पीआई के साथ-साथ चिकित्सकों के साथ मिलकर काम कर रहे हैं, ताकि ओरल कैंसर में कीमोरेसिस्टेंस और पुनरावृत्ति का समर्थन करने वाले आणविक नेटवर्क को समझा जा सके। बहु-संस्थागत, बहु-पीआई दृष्टिकोण के साथ, हम इसे विभिन्न कोणों से समझने की कोशिश कर रहे हैं, जिसमें ट्रांसक्रिप्शनल रीप्रोग्रामिंग, एपिजेनेटिक रीप्रोग्रामिंग, मेटाबॉलिक रीप्रोग्रामिंग और इम्यून मॉड्यूलेटर शामिल हैं। मेरी प्रयोगशाला ट्रांसक्रिप्शनल रीप्रोग्रामिंग पर ध्यान केंद्रित करती है।
अनुसंधान कार्यक्रम
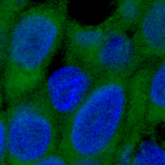
TIF1γ (TRIM33), एक E3 यूबिक्विटिन लिगेज, TGF-β सिग्नलिंग का एक नकारात्मक नियामक है, जो हेमटोपोइजिस में अपनी अच्छी तरह से स्थापित भूमिका के साथ है। कैंसर के संदर्भ में, इसे TGF-β पर अपनी नकारात्मक नियामक भूमिका के साथ एक ट्यूमर सप्रेसर के रूप में माना जाता है, जो ट्यूमर की प्रगति को बढ़ावा देता है। हमारी प्रयोगशाला में हमने दिखाया है कि TIF1γ मौखिक कैंसर कोशिकाओं की स्व-नवीनीकरण क्षमता को नियंत्रित करता है और रोग की पुनरावृत्ति का कारण बनता है। हमने स्व-नवीनीकरण जीन के ट्रांसक्रिप्शनल विनियमन में इसकी भूमिका का पता लगाया है। हमने देखा है कि TIF1γ कई मार्गों द्वारा स्व-नवीनीकरण के प्रेरण के लिए आवश्यक है। वर्तमान में, हम इस मार्ग के अपस्ट्रीम नियामकों पर ध्यान केंद्रित कर रहे हैं। हम अनुवाद के बाद के संशोधनों की पहचान करने का भी प्रयास कर रहे हैं, जैसे फॉस्फोराइलेशन या एसिटिलेशन जो अणु को सक्रिय करता है। खोजे जाने वाला एक और महत्वपूर्ण पहलू है की भूमिका मौखिक कैंसर के रोगियों में प्रचलित जीन के उत्परिवर्तन।
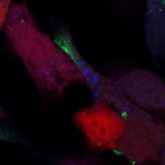
सीएससी एक विशेष माइक्रोएनवायरनमेंट में रहते हैं जिसे 'सीएससी आला' कहा जाता है, जो सेल-सेल इंटरैक्शन या स्रावित अणुओं के माध्यम से प्रेरित विभिन्न सिग्नलिंग मार्गों के ऑर्केस्ट्रेशन के परिणामस्वरूप बनाए रखा जाता है। आला स्व-नवीनीकरण क्षमता, चिकित्सीय प्रतिरोध के रखरखाव में मदद करता है, और बदले में रोग की पुनरावृत्ति को नियंत्रित करता है। हम मौखिक कैंसर में सीएससी विनियमन में इफ़ए2/इफ़्रिनबी1 सिग्नलिंग की भूमिका को स्पष्ट कर रहे हैं। हमारे परिणाम बताते हैं कि लिगैंड और रिसेप्टर का सतही स्थानीयकरण मौखिक कैंसर सीएससी और पुनरावृत्ति के विनियमन में एक भूमिका निभाता ह ्परिवर्तन इस मार्ग के मॉड्यूलेशन में महत्वपूर्ण हो सकते हैं।
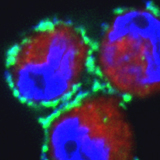
मेजबान रक्षा पेप्टाइड्स (HDPs) का कार्य, जो जन्मजात प्रतिरक्षा प्रणाली का एक अभिन्न अंग है, को हाल ही में मेम्ब्रेनोलिटिक रोगाणुरोधी गतिविधि से इम्यूनोरेग्यूलेशन में पुनः असाइन किया गया है। इस धारणा के विपरीत कि HDPs की एंटीट्यूमर गतिविधि उनकी मेम्ब्रेनोलिटिक गतिविधि पर निर्भर करती है, हमने देखा कि इम्यूनोमॉडुलेटर्स के माध्यम से HDP-प्रेरित सिग्नलिंग कैंसर कोशिकाओं में एपोप्टोसिस की ओर ले जाती है। हमने स्थापित किया कि पेप्टाइड IL6/IL6R/gp130 कॉम्प्लेक्स से जुड़कर इसके डाउनस्ट्रीम सिग्नलिंग को नियंत्रित करता है। JAK/STAT गतिविधि को बाधित करने वाले IL6 अवरोधकों के विपरीत, SSTP1 प्रोलिफ़ेरेटिव IL6/JAK/STAT सिग्नलिंग को एपोप्टोटिक IL6/JNK/AP1 मार्ग पर स्थानांतरित करता है। इसके अलावा, हम दिखाते हैं कि उच्च IL6Rα स्तर व्यक्त करने वाली कैंसर कोशिकाएँ, जैसे ट्रिपल-नेगेटिव ब्रेस्ट कैंसर (TNBC), कम के जवाब में एपोप्टोसिस से गुजरती हैं। SSTP1 की सांद्रता, जो हेमोलिसिस को प्रेरित नहीं करती है, गैर-विशिष्ट मेम्ब्रेनोलिटिक गतिविधि का परिणाम है। इस प्रकार, हमारा अध्ययन नैदानिक उपयोग के लिए अनुवाद के लिए पहचाने गए लक्ष्यों के साथ HDPs के महत्व पर प्रकाश डालता है।

एकल कोशिका जीवविज्ञान काफी हद तक विषम कोशिका आबादी से उप-आबादी का पता लगाने और अलग करने पर निर्भर करता है। भले ही एंटीबॉडी पारंपरिक रूप से इस उद्देश्य के लिए उपयोग किए जाते हैं, लेकिन कुछ संदर्भों में उनकी प्रासंगिकता सीमित है, खासकर जब लक्ष्य एक इंट्रासेल्युलर अणु होता है। पहली बार हमने फ्लोरोफोर-टैग किए गए बाइंडिंग पेप्टाइड का उपयोग करके इंट्रासेल्युलर मार्कर की अभिव्यक्ति के आधार पर कोशिकाओं की लाइव सॉर्टिंग की एक सरल, लागत प्रभावी और कुशल विधि दिखाई है। हमारे परिणाम साबित करते हैं कि हमारे पेप्टाइड TM2 का उपयोग HIRA की विभेदक अभिव्यक्ति वाली कोशिकाओं को अलग करने के लिए किया जा सकता है।
ट्यूमर विशिष्ट लक्ष्य पर टैग किए गए निकट अवरक्त (NIR) रंगों का उपयोग करके फ्लोरोसेंट-आधारित ऑप्टिकल इमेजिंग सर्जिकल मार्जिन भविष्यवाणी के लिए एक इष्टतम उपकरण है। हमने दिखाया है कि TM1-IR680, प्रीक्लिनिकल विश्लेषण में सर्जिकल मार्जिन भविष्यवाणी के लिए आदर्श है। दिलचस्प बात यह है कि पेप्टाइड लिम्फ नोड्स का पता लगाने के लिए पर्याप्त संवेदनशील था, जो उपनिवेशण से पहले फैले हुए ट्यूमर कोशिकाओं को आश्रय देते थे, जिन्हें पारंपरिक हिस्टोपैथोलॉजी द्वारा पहचानना असंभव था।
इन विट्रो और इन विवो माउस मॉडल का उपयोग करके मौखिक कैंसर के जीव विज्ञान का अध्ययन किया जा सकता है। हमने एल्गिनेट मैट्रिक्स पर 3D सह-संस्कृति मॉडल सफलतापूर्वक तैयार किया है, जहाँ हम ट्यूमर फाइब्रोब्लास्ट और ट्यूमर कोशिकाओं को शामिल कर सकते हैं। हम मौखिक कैंसर के लिए ऑर्गेनोइड मॉडल तैयार करने की प्रक्रिया में हैं, जिसका उपयोग दवा स्क्रीनिंग के लिए प्रभावी रूप से किया जा सकता है। हमने ज़ेनोग्राफ़्ट्स, ऑर्थोटोपिक मॉडल और मानवकृत ऑर्थोटोपिक PDX मॉडल की पीढ़ी भी स्थापित की है।
वर्तमान अनुसंधान अनुदान
-
2026 2023
-
2025 2022
चिकित्सीय उद्देश्य (सीओ-पीआई) के लिए एसोफैगल स्क्वैमस सेल कार्सिनोमा में एक नई रणनीति के रूप में विसफैटिन-पीएके4 का विभेदक निषेध।
Indian Council of Medical Research
-
2024 2021
कैंसर और एपोप्टोसिस (Co-PI) में कार्यात्मक सूक्ष्मनलिका पुनर्गठन में आवश्यक प्रोटीन, फोड्रिन की भूमिका का अन्वेषण।
Indian Council of Medical Research
पिछले/पूर्ण अनुसंधान अनुदान
-
वर्चुअल नेशनल ओरल कैंसर इंस्टीट्यूट ओरल कैंसर की प्रगति का अध्ययन करने के लिए पशु मॉडल सिस्टम का विकास
Department of Biotechnology [DBT] 2018-2022ओएससीसी स्टेम कोशिकाओं की स्व-नवीकरण क्षमता के विनियमन में TIF1γ की भूमिका का मूल्यांकन
Department of Science & Technology [DST] 2016-2019लक्षित चिकित्सा विकसित करने के लिए मौखिक कैंसर स्टेम कोशिकाओं को बनाए रखने वाले सिग्नलिंग नेटवर्क की विशेषता का निर्धारण
Department of Science and Technology 2011-2014पेप्टाइड-आधारित सीएससी जांच का उपयोग करके मौखिक स्क्वैमस सेल कार्सिनोमा के लिए पूर्वानुमान मार्कर विकसित करने के लिए मौखिक कैंसर स्टेम कोशिकाओं के सतह मार्कर हस्ताक्षर की पहचान करना
Department of Biotechnology 2011-2014
सहयोग
-
सहयोग
1. डॉ. नेबू अब्राहम जॉर्ज, सहायक प्रोफेसर, सर्जिकल ऑन्कोलॉजी, आरसीसी, तिरुवनंतपुरम।
-
एक बहुकेन्द्रीय परियोजना के एक भाग के रूप में, वी एन ओ सी आई
1. प्रोफेसर तापस के कुंडू, प्रोफेसर, आणविक जीवविज्ञान और आनुवंशिकी इकाई विभाग, जवाहरलाल नेहरू उन्नत वैज्ञानिक अनुसंधान केंद्र, बैंगलोर
2. डॉ. अन्नपूर्णी रंगराजन, एसोसिएट प्रोफेसर, आणविक प्रजनन, विकास और आनुवंशिकी, भारतीय विज्ञान संस्थान, बैंगलोर
3. डॉ. बीरेंद्रनाथ बनर्जी, एसोसिएट प्रोफेसर, जैव प्रौद्योगिकी स्कूल, किल्ट स्कूल ऑफ भुवनेश्वर, उड़ीसा
4. डॉ. देबनाथ पाल, एसोसिएट प्रोफेसर, कम्प्यूटेशनल और डेटा विज्ञान, भारतीय विज्ञान संस्थान, बैंगलोर, कर्नाटक
5. डॉ. सुभाषिनी सदाशिवम, राष्ट्रीय जैविक विज्ञान केंद्र, बैंगलोर
6. प्रो. अनुपम चटर्जी, प्रोफेसर, जैव प्रौद्योगिकी और जैव सूचना विज्ञान, उत्तर-पूर्वी हिल विश्वविद्यालय, शिलांग
7. प्रो. पार्थ प्रतिम मजूमदार, प्रतिष्ठित प्रोफेसर, जीनोमिक्स, राष्ट्रीय जैव चिकित्सा जीनोमिक्स संस्थान, पश्चिम बंगाल
8. प्रो. रामास्वामी सुब्रमण्यम, वरिष्ठ प्रोफेसर, विज्ञान की उन्नति के लिए प्रौद्योगिकी (टीएएस), राष्ट्रीय जैविक विज्ञान केंद्र, बैंगलोर
9. प्रो. सौम्यदीप्ता पाइने, प्रोफेसर, भारतीय सार्वजनिक स्वास्थ्य संस्थान, हैदराबाद
